电解质——离子化合物或共价化合物 非电解质——共价化合物
注意:①电解质、非电解质都是化合物 ②SO2、NH3、CO2等属于非电解质
③强电解质不等于易溶于水的化合物(如BaSO4不溶于水,但溶于水的BaSO4全部电离,故BaSO4 为强电解质)——电解质的强弱与导电性、溶解性无关。
3、电离平衡:在一定的条件下,当电解质分子电离成 离子的速率 和离子结合成 时,电离过程就达到了 平衡状态 ,这叫电离平衡。
4、影响电离平衡的因素:
A、温度:电离一般吸热,升温有利于电离。
B、浓度:浓度越大,电离程度 越小 ;溶液稀释时,电离平衡向着电离的方向移动。C、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会减弱电离。D、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。
5、电离方程式的书写:用可逆符号 弱酸的电离要分布写(第一步为主)
6、电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数。叫做电离平衡常数,(一般用Ka表示酸,Kb表示碱。)
表示方法:ABA++B- Ki=[ A+][B-]/[AB]
7、影响因素:
a、电离常数的大小主要由物质的本性决定。
b、电离常数受温度变化影响,不受浓度变化影响,在室温下一般变化不大。
C、同一温度下,不同弱酸,电离常数越大,其电离程度越大,酸性越强。如:H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO
二、水的电离和溶液的酸碱性
1、水电离平衡:
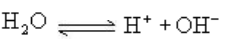
水的离子积:KW= c[H+]·c[OH-]
25℃时,[H+]=[OH-] =10-7 mol/L ; KW= [H+]·[OH-] = 1_10-14
注意:KW只与温度有关,温度一定,则KW值一定
KW不仅适用于纯水,适用于任何溶液(酸、碱、盐)
2、水电离特点:(1)可逆(2)吸热(3)极弱
3、影响水电离平衡的外界因素:
①酸、碱:抑制水的电离 KW〈1_10-14
②温度:促进水的电离(水的电离是 吸 热的)
③易水解的盐:促进水的电离 KW 〉1_10-14
4、溶液的酸碱性和pH:
(1)pH=-lgc[H+]
(2)pH的测定方法:
酸碱指示剂—— 甲基橙 、石蕊 、酚酞 。
变色范围:甲基橙3.1~4.4(橙色) 石蕊5.0~8.0(紫色) 酚酞8.2~10.0(浅红色)
pH试纸—操作 玻璃棒蘸取未知液体在试纸上,然后与标准比色卡对比即可 。
注意:①事先不能用水湿润PH试纸;②广泛pH试纸只能读取整数值或范围
三、混合液的pH值计算方法公式
1、强酸与强酸的混合:(先求[H+]混:将两种酸中的H+离子物质的量相加除以总体积,再求其它) [H+]混=([H+]1V1+[H+]2V2)/(V1+V2)
2、强碱与强碱的混合:(先求[OH-]混:将两种酸中的OH?离子物质的量相加除以总体积,再求其它) [OH-]混=([OH-]1V1+[OH-]2V2)/(V1+V2) (注意:不能直接计算[H+]混)
3、强酸与强碱的混合:(先据H++ OH-==H2O计算余下的H+或OH-,①H+有余,则用余下的H+数除以溶液总体积求[H+]混;OH-有余,则用余下的OH-数除以溶液总体积求[OH-]混,再求其它)
四、稀释过程溶液pH值的变化规律:
1、强酸溶液:稀释10n倍时,pH稀=pH原+n (但始终不能大于或等于7)
2、弱酸溶液:稀释10n倍时,pH稀〈pH原+n (但始终不能大于或等于7)
3、强碱溶液:稀释10n倍时,pH稀=pH原-n (但始终不能小于或等于7)
4、弱碱溶液:稀释10n倍时,pH稀〉pH原-n (但始终不能小于或等于7)
5、不论任何溶液,稀释时pH均是向7靠近(即向中性靠近);任何溶液无限稀释后pH均接近7
6、稀释时,弱酸、弱碱和水解的盐溶液的pH变化得慢,强酸、强碱变化得快。
五、强酸(pH1)强碱(pH2)混和计算规律w
.w.w.k.s.5.u.c.o.m
1、若等体积混合
pH1+pH2=14 则溶液显中性pH=7
pH1+pH2≥15 则溶液显碱性pH=pH2-0.3
pH1+pH2≤13 则溶液显酸性pH=pH1+0.3
2、若混合后显中性
pH1+pH2=14 V酸:V碱=1:1
pH1+pH2≠14 V酸:V碱=1:10〔14-(pH1+pH2)〕
六、酸碱中和滴定:
1、中和滴定的原理
实质:H++OH—=H2O 即酸能提供的H+和碱能提供的OH-物质的量相等。
2、中和滴定的操作过程:
(1)仪②滴定管的刻度,O刻度在上 ,往下刻度标数越来越大,全部容积 大于 它的最大刻度值,因为下端有一部分没有刻度。滴定时,所用溶液不得超过最低刻度,不得一次滴定使用两滴定管酸(或碱),也不得中途向滴定管中添加。②滴定管可以读到小数点后 一位 。
(2)药品:标准液;待测液;指示剂。
(3)准备过程:
准备:检漏、洗涤、润洗、装液、赶气泡、调液面。(洗涤:用洗液洗→检漏:滴定管是否漏水→用水洗→用标准液洗(或待测液洗)→装溶液→排气泡→调液面→记数据V(始)
(4)试验过程
3、酸碱中和滴定的误差分析
误差分析:利用n酸c酸V酸=n碱c碱V碱进行分析
式中:n——酸或碱中氢原子或氢氧根离子数;c——酸或碱的物质的量浓度;
V——酸或碱溶液的体积。当用酸去滴定碱确定碱的浓度时,则:
c碱=
上述公式在求算浓度时很方便,而在分析误差时起主要作用的是分子上的V酸的变化,因为在滴定过程中c酸为标准酸,其数值在理论上是不变的,若稀释了虽实际值变小,但体现的却是V酸的增大,导致c酸偏高;V碱同样也是一个定值,它是用标准的量器量好后注入锥形瓶中的,当在实际操作中碱液外溅,其实际值减小,但引起变化的却是标准酸用量的减少,即V酸减小,则c碱降低了;对于观察中出现的误差亦同样如此。综上所述,当用标准酸来测定碱的浓度时,c碱的误差与V酸的变化成正比,即当V酸的实测值大于理论值时,c碱偏高,反之偏低。
同理,用标准碱来滴定未知浓度的酸时亦然。
七、盐类的水解(只有可溶于水的盐才水解)
1、盐类水解:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应。
2、水解的实质: 水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合,破坏水的电离,是平衡向右移动,促进水的电离。
3、盐类水解规律:
①有弱 才水解,无弱不水解,越弱越水解;谁 强显谁性,两弱都水解,同强显中性。
②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强。 (如:Na2CO3>NaHCO3)
4、盐类水解的特点:(1)可逆(与中和反应互逆)(2)程度小(3)吸热
5、影响盐类水解的外界因素:
①温度:温度越 高 水解程度越大(水解吸热,越热越水解)
②浓度:浓度越小,水解程度越 大 (越稀越水解)
③酸碱:促进或抑制盐的水解(H+促进 阴离子 水解而 抑制 阳离子水解;OH-促进阳离子水解而抑制阴离子水解)
6、酸式盐溶液的酸碱性:
①只电离不水解:如HSO4- 显 酸 性
②电离程度>水解程度,显 酸 性 (如: HSO3-、H2PO4-)
③水解程度>电离程度,显 碱 性(如:HCO3-、HS-、HPO42-)
7、双水解反应:
(1)构成盐的阴阳离子均能发生水解的反应。双水解反应相互促进,水解程度较大,有的甚至水解完全。使得平衡向右移。
(2)常见的双水解反应完全的为:Fe3+、Al3+与AlO2-、CO32-(HCO3-)、S2-(HS-)、SO32-(HSO3-);S2-与NH4+;CO32-(HCO3-)与NH4+其特点是相互水解成沉淀或气体。双水解完全的离子方程式配平依据是两边电荷平衡,如:2Al3++ 3S2- + 6H2O == 2Al(OH)3↓+3H2S↑
8、盐类水解的应用:
水解的应用 |
实例 |
原理 |
1、净水 |
明矾净水 |
Al3++3H2O? Al(OH)3(胶体)+3H+ |
| 2、去油污 | 用热碱水冼油污物品 |
CO32-+H2O? HCO3-+OH- |
3、药品的保存 |
①配制FeCl3溶液时常加入少量盐酸 |
Fe3++3H2O? Fe(OH)3+3H+ |
②配制Na2CO3溶液时常加入少量NaOH |
CO32-+H2O? HCO3-+OH- |
|
4、制备无水盐 |
由MgCl2·6H2O制无水MgCl2 在HCl气流中加热 |
若不然,则: MgCl2·6H2OMg(OH)2+2HCl+4H2O Mg(OH)2MgO+H2O |
5、泡沫灭火器 |
用Al2(SO4)3与NaHCO3溶液混合 |
Al3++3HCO3-=Al(OH)3↓+3CO2↑ |
6、比较盐溶液中离子浓度的大小 |
比较NH4Cl溶液中离子浓度的大小 |
NH4++H2O? NH3·H2O+H+ c(Cl-)>c(NH4+)>c(H+)>c(OH)- |
Tag: 化学 高中资料 高二 高二化学知识点